

在科研界,免疫共沉淀(Co-IP)无疑是磨人的小妖精,小师弟说总是分分钟被虐的体无完肤,糟心的实验结果更是让实验汪们分分钟想去“狗带”。
该如何征服这个磨人的小妖精,对症下药才行,幸得中洪技术前辈积累了不少经验,中洪君特此奉上,希望能助大家一臂之力。
一. 实验原理及优缺点
免疫共沉淀(Co-Immunoprecipitation)是以抗体和抗原之间的专一性作用为基础的用于研究蛋白质相互作用的经典方法。是确定两种蛋白质在完整细胞内生理性相互作用的有效方法。
免疫共沉淀的设计理念是,假设一种已知蛋白是某个大的蛋白复合物的组成成员,那么利用这种蛋白的特异性抗体,就可能将整个蛋白复合物从溶液中“拉”下来(常说的“pull-down”),进而可以用于鉴定这个蛋白复合物中的其他未知成员。免疫共沉淀的特点可以概括为两点,第一是天然状态,第二是蛋白复合物。

二. 免疫共沉淀实验步骤
1.用RIPA裂解缓冲液裂解细胞;
2. 用PBS配制成50%的protein A/G-agarose工作液;
3. 在样品中以每1ml中加100μl的比例,加入50%的Protein A/G agarose工作液。水平摇床4℃摇动10min(该步骤的目的是去除非特异性结合的蛋白);
(实拍图)
4. 4℃,14000g离心15min,将上清转移到一个新的离心管中,去除protein A/G-agraose微球;
5. 使用BCA法或者其他方法测定总蛋白的浓度;
6. 加入一定体积的一抗,至总体积约为500μl;
7. 用摇床缓慢摇动抗原抗体混合物,4℃过夜;
注意:如果如果下游用于激酶或磷酸酶的酶活测定,则最好将11步改为室温孵育2h;
8. 14000g离心5s,收集沉淀,并且用预冷的洗涤缓冲液(或者预冷的PBS)洗涤3遍(每次加入800μl)
9.(用合适体积的上样缓冲液重悬)收集上清,用于进一步的下游SDS-PAGE、western-blot或者质谱分析。通过免疫共沉淀,确定结合蛋白。
三.常见问题解解决办法
1、抗体洗脱过多 ,怎么办?
解决办法:降低抗体用量;在进行IP前将抗体交联到珠子上;使用梯度甘氨酸缓冲洗脱液。
2、洗脱液中检测不到靶蛋白 ,怎么办?
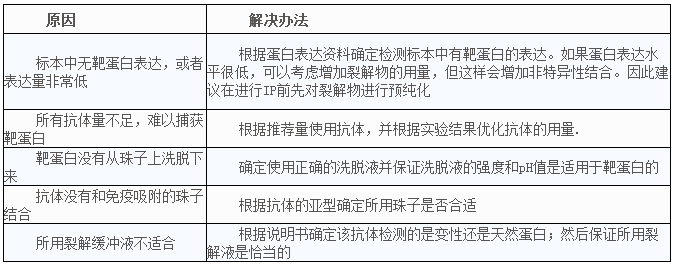
3、未检测到目得蛋白或蛋白很少,怎么办?
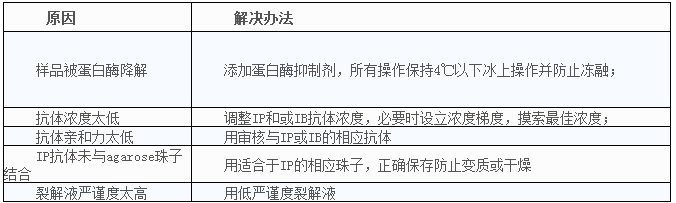
4、目得蛋白高背景,怎么办?

5、免疫沉淀应该如何配制细胞裂解液?
答:细胞裂解采用温和的裂解条件,不能破坏细胞内存在的所有蛋白质-蛋白质相互作用或抗原的结构,多采用非离子变性剂(NP40 或Triton X-100)。每种细胞的裂解条件是不一样的,通过经验确定。不能用高浓度的变性剂(0.2%SDS),细胞裂解液中要加各种酶抑制剂。
四. 应用
1、肿瘤:鼻咽癌细胞中P53相结合蛋白质的分离和鉴定:免疫共沉淀与LC2ESI2MS/MS分析相结合的方法对HNE1细胞蛋白条带3鉴定的P53相互作用蛋白之一HSP78进行了验证。首次在鼻咽癌细胞中鉴定了九个P53结合蛋白,为阐明鼻咽癌中P53蛋白聚集及失活的机制提供了重要依据和线索。
2、酶和病毒:应用免疫共沉淀技术验证新基因AngRem104和糖皮质激素受体特异延伸因子蛋白在哺乳动物细胞中的相互作用,为进一步研究AngRem104的生理功能奠定基础。
3、信号转导:通过免疫共沉淀证实了黑色素瘤相关抗原MAAT1p115与LRP6之间的相互作用。
4、寄生虫:免疫共沉淀证明了天然的PfPP5和恶性疟原虫的热休克蛋白90之间的相互作用,PfPP5在恶性疟原虫寄生生长和信号途径过程中起决定性作用。