

最近在不同技术论坛上溜达加上客户的来电咨询,发现 Co-IP 免疫共沉淀的实验小伙伴做得并不是很顺利,遇到的问题也是千奇百怪,有什么条带也没有检测到的,有泳道一片漆黑的,有出了条带但位置大小还不对,真是让小伙伴们伤透了脑筋,万变不离其踪,做实验之前我们先系统的了解一下实验各个环节的一些基本概念和注意事项,以及如何设置完整的对照以便出问题时快速分析原因。
免疫共沉淀实验原理介绍:
免疫共沉淀(Co-Immunoprecipitation),简称 Co-IP,其原理是当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来, 如果用蛋白质 X 的抗体 anti-X(通常称为 IP 抗体)将 X 特异地抓住并沉淀下来,那么与 X 在体内结合的蛋白质 Y 或者 Z 等也能共同被沉淀下来。目前多用 protein A 或 G 预先固化在琼脂糖或者磁珠 beads 上,protein A 或 G 可以结合各种抗体,具有通用性,当然它们结合不同种属来源的抗体的亲和力有差异,比如 Protein A 结合兔抗的结合力比 G 稍强, 具体需参考产品的说明书。
因此利用 Co-IP 实验有以下作用:
(1)测定两种甚至更多种蛋白质是否在体内结合;
(2)鉴定一种特定蛋白质的作用搭档;
(3)分离得到天然状态的相互作用蛋白复合物。
不同材质的 Beads:
早期的产品 beads 是采用琼脂糖做成的微球,通过离心沉淀到管底,因颗粒小容易被搅动起来,因此在 wash 的步骤移液动作要非常小心,不能吸走了 beads 也不能残留太多的液体,否则靶蛋白有损失或者残留液体可能导致假阳性信号,而且琼脂糖的beads 为多孔结构在长时间的孵育过程中也会有各种蛋白质进入到孔隙中在最后洗脱时都被煮出来了而导致背景不干净,逐渐新的材质磁性 beads 就诞生了,磁珠采用磁力架沉淀,沉淀清洗方便又快速,所以越来越多的实验室采用 Co-IP 磁珠, 如 Bio-Rad SurebeadsTM。
实验对照的设置:
一个成功的 Co-IP 实验,首先得证明靶蛋白 X 和预测的相互作用的蛋白 Y 存在于蛋白质样品中,所以抽出来的蛋白样品要直接检测一下 X 和 Y 的存在,这个一般称为 Input。
然后要证明 IP 抗体是不是能拉下来靶蛋白,做完IP后要检测一下靶蛋白,这里要特别注意了,很多实验室用western的一抗作为 IP 抗体,觉得 WB 能行IP也一定能抓住靶蛋白,这可是不一定的,因为 western 检测时靶蛋白是变性的状态,空间结构都打开了,很多抗体在制备时使用的是合成的肽段作为抗原,这样的抗体不一定能识别非变性状态下折叠起来的靶蛋白,只有实验验证后才知道是否能用于 IP 实验,所以选 IP 抗体时一定要注意抗体的介绍上提到的 application,可能会有 ChIP, Flow Cyt, ICC/IF, IHC-P, IP, WB 等,而且即使购买的抗体说是可以用于 IP 的,其在不同样品中的效果还是自己检测了才知道, 如果靶蛋白没有出现,就不必急着检测 Y 了,先分析原因,要么 IP 抗体有问题,这个就要换不同的抗体试了,要么 beads 没有结合上 IP 抗体,这个倒是可以通过 WB 来检测是否包被好。
当然如果直接做内源性 Co-IP,就怕 Input 也没有出来,这样就搞不清楚是不是样品本身靶蛋白含量太低或者蛋白抽提没有做好的原因, 遇到这种情况,我只能建议步子小一点,先做过表达的 Co-IP 吧。
IP 后 X,Y 蛋白都能检测到,固然是值得高兴的,但是这结果是不是假阳性呢?还得做个阴性对照,目前看到文献中提到有四种方法:
(1)只加入 beads 不加入 IP 抗体
(2)加入一种不相干的蛋白的抗体作为 IP 抗体
(3)加入正常 IgG 作为 IP 抗体
(4)使用不表达靶蛋白 X 但表达 Y 的蛋白样品做对照。
只有以上对照都放了,出来的结果才是可以去解释的。美美的图片是像这样的:
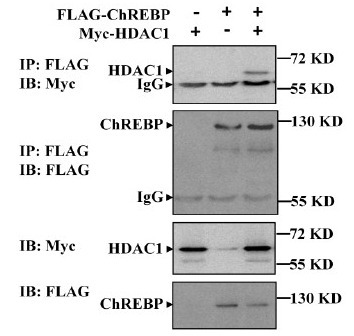
IP 指的是使用这个蛋白的抗体来包被 beads,IB 指使用某抗体去检测沉淀下来的蛋白
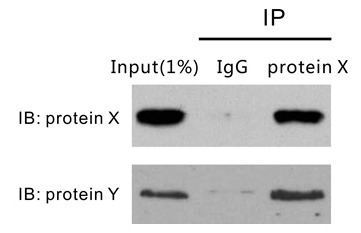
这里的 IgG 就是做阴性对照用
影响 Co-IP 结果成败的其它因素:
除了以上这些在实验设计时需要注意的,蛋白样品的表达,抽提,Co-IP 的 wash 和洗脱步骤也是相当重要的.
(本文转载丁香通)